Kanser hücrelerinin glikoza duydukları ihtiyaç sonucu solunumla ilgili metabolik yolaklarını yeniden düzenlemesi, kanser hücrelerini normal hücrelerden ayıran önemli değişimlerden biridir. Kanser hücrelerindeki solunumla ilgili metabolik değişiklikler 1920’li yıllarda Otto Warburg tarafından ortaya konulmuştur ve uzun zamandır “Warburg fenomeni” olarak bilinmektedir. Kanser hücrelerindeki artmış glikoliz, bu yolağı önemli bir kanser hedefi haline getirir. Glikolizin ilk ve hız kısıtlayıcı basamaklarından biri olan Heksokinaz (HK) enzimi bu açıdan önemli bir hedeftir. Bu sebeple de Heksokinaz, kansere karşı ilaç geliştirme çalışmaları için ideal bir hedef olabilir.
İlk olarak 1979’da bir antispermatojenik ajan olarak tanıtılan Lonidamin (LND), tek bir ajan olarak sınırlı antineoplastik aktiviteye sahiptir, ancak N-hardal alkilleyici ajanlar ve antrasiklinler gibi geleneksel kemoterapötik ajanların yanı sıra hipertermi, radyasyon tedavisi ve fotodinamik terapi aktivitelerini modüle etmede olağanüstü bir potansiyele sahiptir. LND’ nin en kritik özelliği, dozların ~400 mg/m2 eşik seviyesinin altında olması koşuluyla normal dokular üzerinde çok az etkisinin ya da hiç etkisinin olmamasına karşın, çok çeşitli tümörlere karşı seçici aktivite göstermesidir. Bu dozlarda LND, tümör ATP seviyelerini düşürürken tümör hücrelerinde seçici sitozolik asitlenmeye neden olur.
Heksokinaz, glikolizin ilk adımı olan glikozu katalize eden bir enzimdir. LND, heksokinazın inaktivasyonu ile glikolizi inhibe eden, indazol-3-karboksilik asit türevi bir moleküldür (Şekil 1). Ayrıca, LND’nin programlanmış hücre ölümünü (apoptoz) artırabileceğine dair kanıtlar vardır. LND, normal hücrelerde aerobik glikolizi arttırırken, kanser hücrelerinde glikolizi baskılayıcı etki göstermektedir. Bu durum, büyük olasılıkla mitokondriye bağlı heksokinazın inhibisyonu yoluyla gerçekleşmektedir. Ehrlich asit tümör hücrelerinde yapılan daha sonraki çalışmalar, LND’nin hem solunumu hem de glikolizi inhibe ederek hücresel ATP’de bir azalmaya yol açtığını göstermiştir.
LND, mitokondriyal olarak bağlı heksokinaz üzerindeki etkisiyle kanser hücrelerinin enerji metabolizmasına müdahale eden, esas olarak aerobik glikolitik aktiviteyi inhibe eden bir ilaçtır. Bu şekilde LND, radyasyon tedavisi ve bazı sitotoksik ilaçların neden olduğu potansiyel olarak ölümcül hasarlardan kurtulma gibi enerji gerektiren süreçleri bozabilir. Çeşitli kanserler için diğer antikanser ajanlarla kombinasyon halinde LND’nin klinik denemeleri başlamıştır. Bunun nedeni, kanser hücrelerinde enerji metabolizmasını inhibe etme ve antikanser ajanların aktivitesini artırma konusundaki kanıtlanmış yeteneğidir.
İn vitro çalışmalarda, düşük plazma konsantrasyonlarında temozolomid ve LND kombinasyonunun tümör büyümesini engelleyebileceği ve LND’nin, beyin tümörlerinin radyosensitizasyonu için gereken temozolomid dozunu azaltabileceği bildirilmiştir.
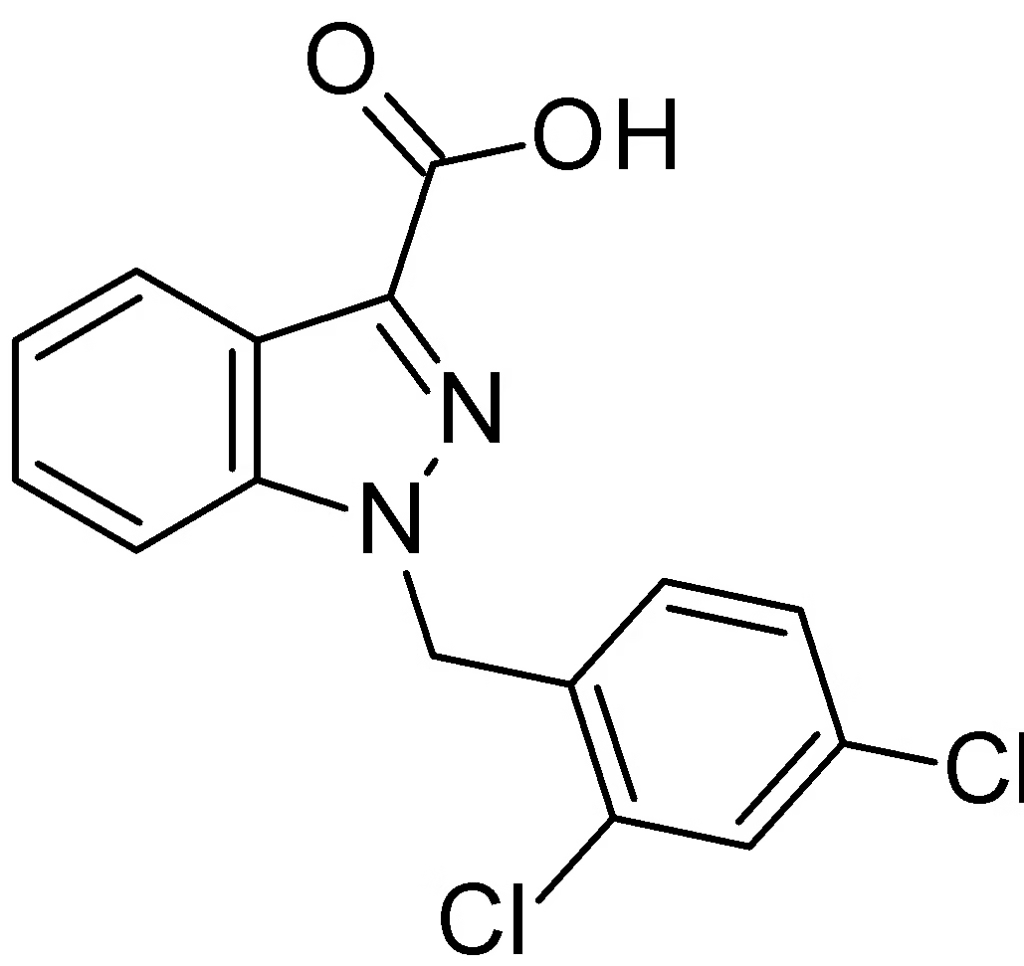
Şekil 1. 1-(2,4-Diklorobenzil)-1H-indazol-3-karboksilik asit.
Bu ilacın tek ticari kaynağı olan İtalya’nın Roma kentindeki Angelini Pharmaceuticals firmasının 2006 yılında üretimini durdurmasından bu yana, ele alınması gereken temel sorunlar, LND’nin GMP koşulları altında üretilmesidir. Ayrıca LND, etkili anti-kanser ajanların aktivitesini güçlü bir şekilde arttırmasının yanı sıra, potansiyel olarak daha az toksik “hedefe yönelik antitümör ajanları” arasında yer almaya başlamıştır.
Ele alınması gereken bir diğer sorun, LND’nin nötr pH’ta sınırlı çözünürlüğüdür. Doz programlarını doğru bir şekilde kontrol etmek için intravenöz uygulama ile uygulanabilen daha çözünür türevlere ihtiyaç vardır.
Kaynaklar
1. Nath K, Guo L, Nancolas B, Nelson DS, Shestov AA, Lee SC, Roman J, Zhou R, Leeper DB, Halestrap AP, Blair IA, Glickson JD. Mechanism of antineoplastic activity of lonidamine. Biochim Biophys Acta. 2016;1866(2):151-162. doi: 10.1016/j.bbcan.2016.08.001.
2. Lonidamine | C15H10Cl2N2O2 | CID 39562 – PubChem









