ÜÇÜNCÜ NESİL TİROZİN KİNAZ İNHİBİTÖRÜ: OSİMERTİNİB

Akciğer kanseri, beş yıllık sağ kalımı %10-15 olan, tedavideki tüm gelişmelere rağmen dünyada kansere bağlı ölümlerin nedenlerinden birisidir. Akciğer kanserinin, küçük hücreli olmayan akciğer kanseri (KHOAK) ve küçük hücreli akciğer kanseri (KHAK) olmak üzere iki temel türü vardır. KHOAK, akciğer kanserlerinin %80 ila 85’ini, KHAK ise akciğer kanserlerinin %10 ila 15’ini oluşturur ve tedavi şekilleri de farklıdır.
KHOAK’nin mukus salgılayan hücrelerde görülen (%40), hava yollarının içini örten yassı hücreler olan skuamoz hücrelerde görülen (%25-30), akciğerlerin herhangi bir yerinde görülen ve hızlı büyüme / yayılma eğilimi olan üç ana türü bulunur.
Başlıca riskler; tütün kullanımı (%80’ni sigara kullanımı veya pasif içicilik), hava kirliliği, asbest ve diğer kimyasallara maruziyet, kişisel veya ailede akciğer kanseri geçmişi bulunması, önceden radyasyon terapisi almış olmak şeklinde sayılabilir.
Küçük hücreli olmayan akciğer kanseri, sıfırdan dörde kadar beş aşamaya sahiptir. Rakam büyüdükçe hastalığın ciddiyeti artar. Görünüm ve tedavi evreye bağlı olarak değişir. Dördüncü evre genel olarak iyileştirilebilir değildir, bu nedenle tedavisi şikayetleri azaltmayı amaçlar.
Akciğer kanseri gelişiminde pek çok büyüme faktörü ve reseptörü etki gösterir. Bu büyüme faktörlerinin başında epidermal büyüme faktörü (EGF) ve epidermal büyüme faktörü reseptörü (EGFR) gelir. KHOAK’de karakteristik olarak EGFR ve ligandları aktive olurken, küçük hücreli KHAK’de nöropeptidler ve reseptörleri aktive olur. EGF ilk kez Dr. Stanley Cohen tarafından 1962 yılında erkek fare çene altı tükürük bezinde izole edilmiş olan, 53 aminoasitlik bir polipeptitdir. Sporn ve Todaro, 1970 yılında akciğer kanseri de dahil olmak üzere pek çok solid tümörün patojenezinin ve progresyonunun lokal parakrin ve otokrin büyüme faktörleri ile regüle edildiğini bildirmişlerdir.
EGF’nin, tirozin kinaz aktivitesine sahip transmembran reseptörü olan EGFR’ne bağlandığı 80’li yıllarda tanımlanmıştır. EGFR, 170 kDa ağırlığına sahip tirozin kinaz etkinliğine sahip transmembran glikoprotein olup, hücre yüzeyinde olan bir reseptördür. Hücre yüzeyinde uyarıcı molekülün bağlandığı bölüm, hücre zarı bölümü ve hücre içinde enzim etkisini gösteren bölüm olmak üzere üç kısımdan meydana gelir. Aktifleştiğinde hücre içinde sinyal iletimine ve bunun sonucunda hücre içi değişikliklere yol açar.
EGF ve TGF-α (dönüştürücü büyüme faktörü-alfa) EGFR’nin hücre dışı N terminaline bağlanması ile tirozin kinaz aktivasyonu olur. Tirozin kinaz aktivasyonu ile; mitojenez, apoptozun inhibisyonu, hücre hareketliliğinde artış, protein sekresyonunda artış, hücre adezyonu, invazyon, hücre yaşam süresinde artış, sitokin salımı artışı, anjiogenez ve metastaz gelişimi olur.
EGFR’yi kodlayan gende bir anormallik (değişim, mutasyon) meydana geldiğinde reseptörün çok çalışmasına, bu da kanser hücrelerinin büyüme ve çoğalmasında artışa yol açar. EGF reseptörü normal hücrelerde de bulunur, fakat kanserli hücrelerde aşırı miktarda ifade edilme, ya da mutasyona uğrama eğilimindedir. Akciğerde EGFR, bazal hücreler, Clara hücreleri ve tip Iı pnömositlerde interselüler membranlarda lokalize olup, apikal yüzeylerde, silyalı hücrelerde EGFR ifadesi yoktur.
Hedeflenmiş tedavi, tümörü besleyen damarlar veya büyüme faktörleri gibi kanser hücresinin spesifik yönlerini hedef alan ilaçlardır. Akciğer kanserinde son yıllarda EGFR aktivasyonunu ve fonksiyonunu inhibe eden ajanlar geliştirilmiştir.
Birinci nesil epidermal büyüme faktörü reseptörü-tirozin kinaz inhibitörlerle (EGFR-TKİ)(gefitinib ve erlotinib) (Şekil 1) tedavi, EGFR genindeki mutasyonları aktive ederek direnç gelişimi ile ilişkilendirilmiştir. İkinci nesil EGFR-TKİ’ler (afatinib ve dakomitinib) (Şekil 2) daha sonra daha güçlü inhibitörler olarak geliştirilmiştir, ancak kullanımları mutasyona uğramamış EGFR’nin özgün olmayan hedeflemesi yoluyla artan toksisite ile ilişkilidir. T790M mutasyonunun 2005 yılında keşfi ile üçüncü nesil EGFR-TKİ’leri gündeme gelmiştir. Üçüncü nesil inhibitörler, ATP’nin EGFR’ye bağlanma aktivitesini artıran ve geç evre hastalık için kötü prognoza neden olan kapı bekçisi T790M mutasyonları için spesifiktir. Osimertinib, AstraZeneca İlaçları tarafından geliştirilen oral, üçüncü nesil EGFR-TK inhibitörü bir ilaçtır. Kullanımı, FDA onaylı testlerle tespit edilen T790M mutasyonu için tümör EGFR ifadesinin pozitif olduğu ve birinci nesil bir EGFR tirozin kinaz inhibitörü ile tedaviyi takiben ilerleyen metastatik KHOAK tedavisinde endikedir. Ayrıca, osimertinib’in tedavi sırasında vahşi tip EGFR’yi koruduğu gösterilmiştir, böylece spesifik olmayan bağlanmayı azaltır ve toksisiteyi sınırlar.

Şekil 1. Birinci nesil EGFR-TKİ’ler.

Şekil 2. İkinci nesil EGFR-TKİ’ler .
Osimertinib (Şekil 3), kanser hücresinde mutasyona uğramış EGFR’yi hedefleyen yeni nesil bir kanser ilacı olup, ilerlemiş (4. evre) akciğer kanserinde hastalığın ilerlemesini yavaşlatmak ve hastalığın yayılmasını durdurmak için kullanılır. Osimertinib, amino hidrojenlerden birinin 4-metoksi-1-[3-(dimetilamino)etil] (metil) amino-2-akrilamidofenil grubu ile değiştirildiği, 2-(4-metilindol-2-il)pirimidin-5-amin yapısındaki aminopirimidinler sınıfının bir üyesidir. EGFR T790M mutasyonu pozitif KHOAK tedavisinde (mesilat tuzu olarak) kullanılır. Antineoplastik ajan ve EGFR antagonisti olarak rol oynar.
Osimertinib, ana bileşik konsantrasyonunun yaklaşık %10’unda dolaşan en az iki farmakolojik olarak aktif olan, AZ7550 (N-[4-metoksi-5-[[4-(1-metilindol-3-il)pirimidin-2-il]amino]-2-[metil-[2-(metilamino)etil]amino]fenil]prop-2-enamid) ve AZ5104 (N-[4-metoksi-5-[[4-(1-metilindol-3-il)pirimidin-2-il]amino]-2-[metil-[2 (metilamino)etil]amino]fenil]prop-2-enamid)yapısındaki metabolitlerine dönüştürülür. Biyokimyasal deneyler, AZ7550’nin osimertinib ile benzer potansiyele ve etkinliğe sahip olduğunu, AZ5104’ün ise mutant ve vahşi tip EGFR’ye karşı daha güçlü olduğunu göstermiştir. Ana metabolik yollar oksidasyon (ağırlıklı olarak CYP3A tarafından) ve dealkilasyondur.
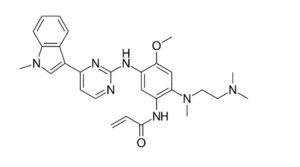
Şekil 3. Osimertinib: N-[2-[2-(Dimetilamino)etil-metilamino]-4-metoksi-5-[[4-(1-metilindol-3-il)pirimidin-2-il]amino]fenil]prop-2-enamit.
Tamamen önlenemese de, hastalığı geliştirme riskini azaltacak adımlardan olan sigara kullanımının bırakılması, hastalık riskini artıran kimyasallara maruziyetinizin sınırlandırılması, meyve ve sebze ağırlıklı, sağlıklı bir beslenme programının sürdürülmesi, düzenli egzersiz gibi yaşam kalitesini artıran faktörler ile kanser riski azaltılabilir.
KAYNAKLAR
1.Osimertinib | C28H33N7O2 | CID 71496458 – PubChem (nih.gov)
2. J.-C. Soria, Y. Ohe, J. Vansteenkiste, T. Reungwetwattana, B. Chewaskulyong, K.H. Lee, A. Dechaphunkul, F. Imamura, N. Nogami, T. Kurata, I. Okamoto, C. Zhou, B.C. Cho, Y. Cheng, E.K. Cho, P.J. Voon, D. Planchard, W.-C. Su, J.E. Gray, S.-M. Lee, R. Hodge, M. Marotti, Y. Rukazenkov, and S.S. Ramalingam, for the FLAURA Investigators N Engl J Med 378;2, 113-125, January 11, 2018.
3. Ceyda Erel KIRIŞOĞLU, Can ÖZTÜRK, Nurdan KÖKTÜRK “Küçük Hücreli Dışı Akciğer Kanserinde Epidermal Büyüme Faktör Reseptörü ve inhibitörlerinin yeri, Solunum, 5(3), 146-152, 2003.
4. Emine Bozkurtlar, Handan Kaya “Akciğer Kanserinde Moleküler Patoloji” Nucl Med Semin 2018;4:26-31.
5. Anne-Pascale Meert, Thierry Berghmans. Küçük Hücreli Dışı Akciğer Kanserinde Hedefe Yönelik Tedaviler: Rutin Uygulamalardaki Yeri. https://www.toraks.org.tr/site/community/downloads/1343 (Son erişim tarihi:15.03.2021)




